INTRODUCCIÓN
Hoy vamos a hablar de la importancia de contar con adecuadas bases fisiológicas del entrenamiento con oclusión vascular.
ENTRENAMIENTO TRADICIONAL VS. ENTRENAMIENTO OCLUSIVO
ENTRENAMIENTO TRADICIONAL:
El entrenamiento tradicional utiliza cargas mecánicas muy elevadas para romper la homeostasis y someter al organismo a un grado de estrés metabólico, mecánico y nervioso.
Sin embargo, es muy importante tener en cuenta que se ha demostrado que someter al organismo a una sucesión de cargas de alta intensidad no solo incrementa el reclutamiento de fibras de forma rápida sino que también agota los depósitos de sustratos energéticos inmediatos, aumenta la frecuencia y la amplitud de la señal electromiográfica e induce una marcada respuesta endocrina.
“Todos estos elementos se relacionan entre sí para que el resultado final del entrenamiento sea un desequilibrio entre la tasa de degradación de proteínas y su tasa de síntesis, que es el mecanismo a través del cual se estimula la síntesis de proteínas contráctiles – actina y miosina – que dará lugar a la hipertrofia muscular.” (Loenneke et. al, 2011).
ENTRENAMIENTO OCLUSIVO:
El entrenamiento oclusivo consiste, por lo tanto, en la restricción del flujo sanguíneo – tanto aferente como eferente – durante un ejercicio de baja intensidad. Esto reduce el aporte arterial y el aclarado venoso; es decir, cambia drásticamente la exigencia metabólica del ejercicio (Manini y Clarck, 2009).
La oclusión siempre se genera en la parte proximal de la extremidad que se desea entrenar.
Para ocluir un miembro pueden utilizarse bandas elásticas, cintas velcro, torniquetes neumáticos electrónicos o manuales y cualquier otro dispositivo de invención casera.
La marca japonesa Kaatsu® comercializa sus propios aparatos, que controlan automáticamente la presión de oclusión, pero son difíciles de conseguir en el mercado.
En la literatura científica, la presión de oclusión se mide en milímetros de mercurio (mmHg) y su valor se emplea para estimar la reducción del flujo sanguíneo inducida por la cincha. Así, se han utilizado presiones que oscilan entre los 50 y más de 200 mmHg (Wernbom et al, 2008). Cuando se utilizan dispositivos que no proporcionan información sobre la presión de la cincha, como bandas elásticas, la medida de oclusión se polariza en oclusión total (la onda de pulso desaparece por completo) y oclusión parcial (se detecta pulso en la zona distal de la cincha).
La sesión de entrenamiento oclusivo más empleada en la investigación se compone, normalmente, de 3 a 5 series hasta alcanzar el fallo volitivo, con una intensidad del 20-50%1RM, un ritmo de ejecución 2:2 y un descanso entre series de 30s-1min. El nivel de oclusión suele ser parcial (Manini y Clark, 2009). Los resultados indican que este tipo de sesiones llevadas a cabo con oclusión total generan dolor, entumecimiento y pérdida notable de sensibilidad en la zona distal de la extremidad durante la ejecución de los ejercicios.
Asimismo la mayoría de los sujetos no son capaces de realizar más de 3 series con descansos de 30 segundos si la oclusión es completa. Normalmente, la presión se mantiene durante los períodos de descanso y es liberada inmediatamente tras finalizar la sesión. El tiempo total de oclusión no suele superar los 10 o 15 minutos por sesión, y suelen realizarse entre 2 y 5 sesiones por semana.
ACUMULACIÓN METABÓLICA Y RESPUESTA HORMONAL
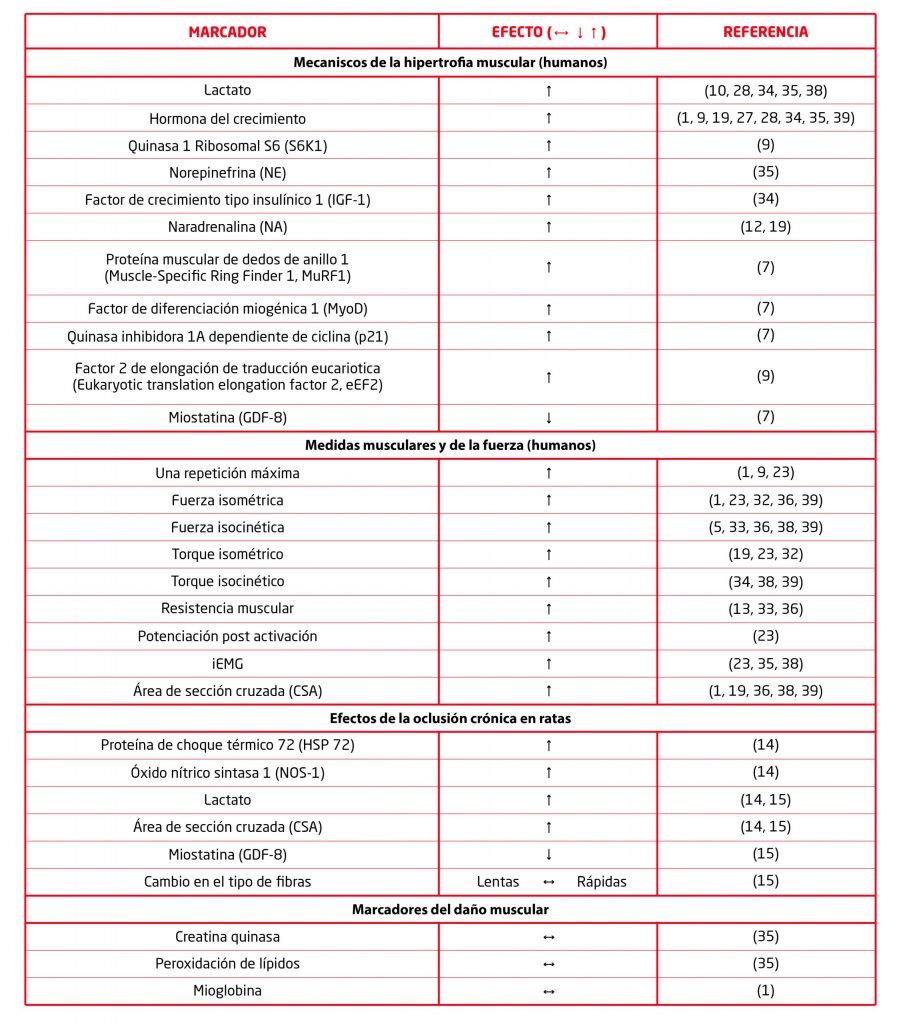
Se ha demostrado que el incremento de la tasa metabólica glucolítica durante el entrenamiento en oclusión, unido a la restricción del retorno venoso, tiene como consecuencia una acumulación de metabolitos de desecho en la zona ocluida. Así, se ha observado un incremento significativo de lactato (La) (Takarada et al, 2000, 2000; Fujita et al, 2007) y, con seguridad, de adenosina, K+ y H+ (Loenneke et al, 2010) tras una sesión de ejercicio con oclusión. Esto conlleva un descenso del pH intramuscular que podría estimular un reflejo químico, mediado por las fibras aferentes III y IV, que estimule la secreción hipofisaria de hormona del crecimiento (GH).
Tras detectar un incremento de hasta 290 veces los valores basales de GH (Takarada et al, 2000), así como una respuesta consistente del ejercicio en oclusión a esta hormona (pierce et al, 2006; Fujita et al, 2007; Takano et al, 2005; Abe et al, 2005; Takarada et al, 2004), se propuso la respuesta a la GH como principal responsable la de hipertrofia tras el entrenamiento en oclusión. En cambio, tanto la relación de la acumulación metabólica con la secreción de GH, como la relación de la GH con el mecanismo de hipertrofia muscular, son controvertidas.
Por ejemplo, si bien existen estudios en los que la cinética del LA (lactato) y la GH (hormona de crecimiento) son coincidentes (Reeves et al, 2006) algunos describieron que, a pesar de que el entrenamiento oclusivo indujo un incremento significativamente mayor de GH que un grupo de entrenamiento en la circulación libre no hubo diferencias en los niveles de lactato alcanzados por ambos grupos. Siguiendo esta misma línea, también se ha observado cómo algunos pacientes con la enfermedad de McArdle, no pueden generar LA, pero sí son capaces de segregar GH tras una sesión de entrenamiento tradicional.
Por otro lado, tampoco se ha comprobado que la GH sea responsable de incrementar la síntesis proteica, ni que influya directamente en el proceso de hipertrofia muscular. En relación a esto, Wilkinson et al, (2006) afirman haber descubierto un aumento significativo del tamaño muscular de un grupo de sujetos que no presentaron ninguna respuesta sistémica a la GH.
Vale la pena aclarar que sí se ha verificado que la administración de GH recombinada no tiene ningún efecto sobre el balance proteico muscular (Loenneke et al, 2010). Por lo tanto, debido a la falta de evidencias de que su efecto anabólico sea directo, parece poco probable que la vía de la GH sea la única que participe en el proceso de hipertrofia muscular (Rennie, 2003).
Concluyendo, la respuesta del factor insulínico de crecimiento 1 (IGF-1) al ejercicio en oclusión también parece ser variable (Abe et al, 2005). Se ha descubierto un incremento de la concentración basal de IGF-1 tras dos semanas de entrenamiento oclusivo y atribuyeron este hecho a un incremento de los valores basales de GH, especulando que el incremento de la actividad de GH podría haber conducido a la respuesta del IGF-1. Sin embargo, los valores de GH no fueron cuantificados en dicho estudio, aunque resultados de otros trabajos han encontrado diferencias en la cinética de la GH y el IGF-1 que hacen insostenible esa relación (Takano et al, 2005).
SÍNTESIS PROTEICA
El desequilibrio y el estrés, inducidos por la carga mecánica del ejercicio, son responsables de que se produzca un incremento en el transporte de aminoácidos dentro de la célula muscular. Esto derivará en un incremento de la síntesis de los componentes proteicos funcionales del músculo: actina y miosina. Por tanto, independientemente del gradiente hormonal, la hipertrofia muscular es el resultado de un desequilibrio entre la tasa de degradación de las proteínas y su tasa de síntesis.
El mecanismo de acumulación metabólica y la elevada respuesta de la GH al ejercicio en oclusión podrían tener un papel únicamente regulador a nivel metabólico y no en el balance de síntesis proteica (Loenneke et al, 2011).
En este sentido, algunos autores han demostrado que pueden producirse adaptaciones estructurales sin elevaciones de los niveles de GH ni de testosterona (Loenneke et al, 2011).
De hecho, el entrenamiento oclusivo ha demostrado incrementar el tamaño muscular a pesar de estimular pobremente la secreción de IGF-1 y no mostrar apenas respuesta a la testosterona (Fujita et al, 2007; Loenneke et al, 2011). Un trabajo ha demostrado que, a diferencia de lo establecido en las recomendaciones del ACSM, la realización de 4 series al fallo con un 30%1RM puede incrementar la tasa de síntesis proteica en la misma medida que si se realizaran con un 90%1RM (Loenneke et al, 2011).
En un interesante estudio de revisión, (Loenneke et al, 2011) se analizó la posible preeminencia del volumen sobre la intensidad en la estimulación de la síntesis proteica, ya que el entrenamiento oclusivo ha demostrado inducir un incremento en la tasa de síntesis proteica tras una sesión de ejercicio con cargas de baja intensidad – 20%1RM – (Fujita et al, 2007; Fry et al, 2010)
A pesar de que aún no se han determinado las causas exactas que conducen a la hipertrofia muscular en el entrenamiento oclusivo, parece claro que éste induce una elevación aguda de la síntesis proteica y que, además, es posible que lo haga sin intervención de hormonas anabólicas como la testosterona o el IGF-1. En vista de estas evidencias, también se ha especulado que los procesos de hipertrofia del entrenamiento tradicional y los entrenamientos oclusivos podrían diferir entre sí (Loenneke et al, 2011).
El estímulo local de ejercicio, incluso de baja intensidad, es absolutamente necesario para inducir la hipertrofia muscular. Se ha observado tanto en humanos como en animales que, fisiológicamente, el entrenamiento con oclusión vascular trae aparejado diversos cambios a nivel corporal. La acumulación de subproductos metabólicos parece ser el mecanismo principal detrás de los beneficios observados con el entrenamiento con oclusión.
La acumulación de lactato en sangre (Gentil y Bottaro, 2006; Takano et al, 2005), en plasma (Fujita et al, 2007; Reeves et al, 2006; Takano et al, 2005; Takarada et al, 2000) y en la célula muscular (Kawada e Ishii, 2005; 2008) debida a la restricción del flujo sanguíneo resulta en el incremento de los niveles de GH. Esto es significativo ya que se ha observado que el incremento de la acidez intramuscular estimula el aumento de los niveles de GH (Takarada et al, 2000). Este incremento en los niveles de GH es mayor que el observado con el entrenamiento de sobrecarga tradicional (Kraemer et al, 1990; 1991).
Ahora, bien la proteína de estrés térmico 72 – HSP 72 -, el óxido nítrico sintasa 1 – NOS-1 – y la miostatina parecen contribuir también al incremento del área de sección cruzada muscular – CSA – (Anderson, 2000; Kawada e Ishii, 2008; McPherron y Lee, 1997; Naito et al, 2000; Schuelke et al, 2004; Tatsumi et al, 2002).
Kawada e Ishii (2008) hallaron que dos semanas de oclusión crónica en ratas provocó un cambio en el tipo de fibras desde lentas a rápidas. Estos autores atribuyen este cambio al reclutamiento adicional de las unidades motoras grandes y sus fibras tipo II asociadas a expensas de la rápida fatiga experimentada por las fibras lentas oxidativas durante la restricción del flujo sanguíneo. Observaron también un incremento de los niveles de HSP 72 en respuesta al entrenamiento con oclusión vascular (Kawada e Ishii, 2005). El incremento de HSP 72 es inducido por estresores tales como el calor, la isquemia, la hipoxia y los radicales libres. Las proteínas HSP 72 actúan como facilitadoras para evitar el plegamiento defectuoso o la agregación defectuosa de proteínas. El incremento en el contenido de HSP 72 ha mostrado atenuar la atrofia, de manera que podrían desempeñar un papel en la hipertrofia inducida por el ejercicio con oclusión vascular (Naito et al, 2000).
El incremento en la expresión de NOS-1 también ha mostrado estimular el crecimiento muscular a través del crecimiento de la activación de las células satélite (Anderson et al, 2000; Tatsumi et al, 2002).
Asimismo, la miostatina es un regulador negativo del músculo, y se ha observado que las mutaciones de este gen resultan en un crecimiento excesivo de la musculatura en ratones, en el ganado y en humanos (McPherron y Lee 1997, Schuelke et al, 2004). La expresión del gen de miostatina se reduce significativamente en respuesta al entrenamiento con oclusión vascular (Kawada e Ishii, 2005).
En ese sentido, (Fujita et al, 2007) mostraron que el entrenamiento con sobrecarga de baja intensidad provoca el incremento de la fosforilación de la quinasa 1 ribosómica S6 (S6K1) y la síntesis de proteínas musculares. También sugirieron que la mejora de la vía de señalización del blanco de rapamicina en mamíferos (mTOR) puede ser otro mecanismo celular importante que podría explicar en parte la hipertrofia inducida por el entrenamiento de baja intensidad con oclusión vascular.
La S6K1 está involucrada en la regulación de la iniciación de la traducción del ARN – mARN – mensajero y parece ser un regulador crítico de la síntesis de proteínas inducida por el ejercicio y de la hipertrofia inducida por el entrenamiento (Baar y Esser, 1999; Reeves et al, 2006). La vía de señalización de la S6K1 también inhibe la quinasa del factor 2 eucariótico de elongación de la traducción (eEF2) reduce la fosforilación de la eEF2 y por lo tanto promueve la elongación y traducción (Wang y Proud, 2006).
Un estudio de seguimiento mostró que la REDD1 (regulador 1 de la respuesta al daño y del desarrollo del ADN) el cual suele expresarse en condiciones de hipoxia, no se incrementa en respuesta al entrenamiento con oclusión incluso aún cuando se produce una elevación del factor 1 alfa inducible por hipoxia – HIF-1 -.
La reducida expresión del mARN para el REDD1 puede ser importante debido a que la reducción del REDD1 aliviaría la inhibición de mTOR, promoviendo la estimulación de la vía de señalización del mTOR, la traducción del ARN y el crecimiento de las células musculares (Drummond et al, 2008). Una posible explicación del incremento en el HIF-1a sin un incremento concomitante en el REDD1 puede ser que existe un factor desconocido que influencie la transcripción de REDD1, de manera que el HIF-1 realizaría la regulación ascendente del REED1, y que otro factor que se incremente debido al ejercicio resulte en la regulación descendente del HIF-1 resultando en una reducción neta del REDD1. También podría existir un factor que inhiba o estimule el efecto del HIF-1 sobre la expresión del REDD1, de manera que aun cuando la expresión de HIF-1 sea alta, su actividad no lo sea. Además, la oclusión en sí misma puede provocar el incremento del HIF-1a pero la reperfusión posterior al ejercicio puede inhibir su acción.
EFECTOS DEL ENTRENAMIENTO CON OCLUSIÓN
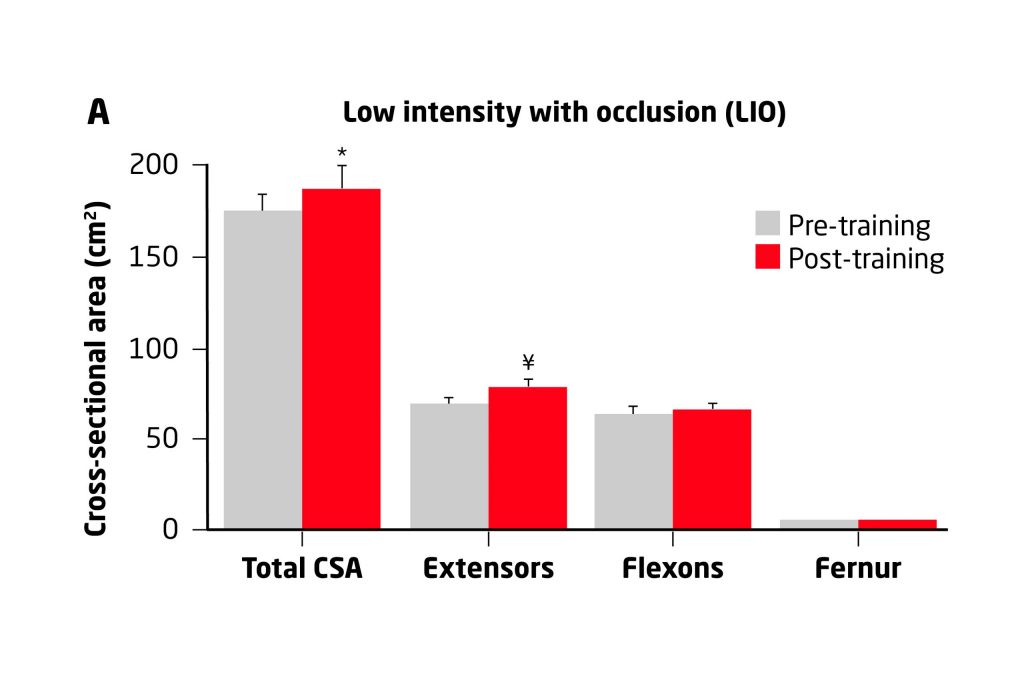
En el año 2004, Takarada et al llevaron a cabo una rigurosa investigación sobre el efecto del entrenamiento de la fuerza de baja intensidad con oclusión. Para ello estudiaron a 18 sujetos que fueron separados en 3 grupos:
– baja intensidad con oclusión (LIO),
– baja intensidad sin oclusión (LI) y
– oclusión sin entrenamiento (VO).
Estos grupos realizaron un protocolo en una máquina isotónica para los extensores de rodilla que consistía en 5 series al 20% de 1RM 2 veces por semana durante 8 semanas, lo cual resulta interesante para analizar los cambios estructurales encontrados.Para analizar los cambios en la sección transversal del músculo se utilizaron imágenes por resonancia magnética de los muslos las cuales mostraron un incremento del 16% solo para los sujetos que realizaron el entrenamiento de baja intensidad con oclusión.
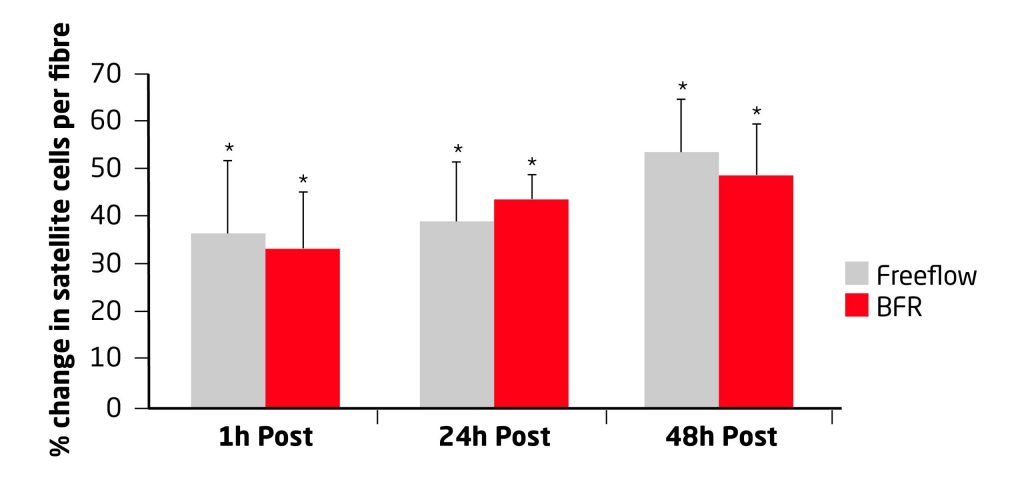
Por último, destacamos el trabajo de Wernbom y col (2013), donde se investigaron los efectos agudos del entrenamiento con oclusión sobre la activación de las vías de señalización principales para la activación de la síntesis de proteínas junto con los cambios en el número de células satélite.
Los sujetos realizaron 5 series al fallo muscular de extensiones unilaterales de rodillas con una intensidad de 30% de 1RM asignándose al azar una sola pierna para realizar el protocolo con oclusión.
Para determinar la activación de las vías de señalización se realizaron biopsias musculares antes del entrenamiento y 1,24 y 48 horas posteriores al mismo.
El entrenamiento con oclusión vascular incrementó la activación tanto temprana (1h) como tardía (24hs.) en la fosforilación de p70S6K, solo tardía (24 hs.) en la fosforilación de p38MAPK, dos quinasas musculares encargadas en activar la síntesis de proteínas, también el número de células satélites por fibra muscular se vio marcadamente incrementado, aunque este último cambio fue encontrado tanto en la pierna que trabajó con obstrucción como en la que no.
ALGUNAS APLICACIONES PRÁCTICAS PARA EL DESARROLLO DE LA HIPERTROFIA MUSCULAR:
El Colegio Americano de Medicina del Deporte (American College of Sports Medicine) recomienda que, para el desarrollo de la hipertrofia muscular en condiciones normales, se realicen entre 6-12 repeticiones al 65% de una repetición máxima (1RM).
Se considera que cualquier intensidad menor a esta no provocará ganancias sustanciales en la fuerza o en la hipertrofia muscular (ACSM Position Stand, 2002).
El entrenamiento con oclusión puede ser un modo de ejercicio único y beneficioso en el ámbito clínico debido a que produce adaptaciones positivas al entrenamiento, pero con una intensidad equivalente a la observada durante actividades físicas cotidianas (10-30% de la máxima capacidad de trabajo) (Abe et al, 2006).
Recientemente, se ha demostrado que la hipertrofia muscular se puede inducir con una intensidad de entrenamiento de hasta el 20% de 1RM siempre que se realice una oclusión vascular moderada (Sumide et al, 2009). El entrenamiento de baja intensidad con oclusión vascular también ha mostrado ser beneficioso para atletas (Takarada et al, 2005), para pacientes que se encuentran realizando un programa de rehabilitación post operatorio, particularmente para aquellos que han sufrido lesiones del ligamento cruzado anterior (ACL), y para pacientes que realizan un programa de rehabilitación cardíaca y para individuos ancianos (Takano et al, 2005; Takarada et al, 2000).
Algunos investigadores han indicado que el entrenamiento con oclusión vascular también puede ser beneficioso para los astronautas durante la realización de viajes espaciales (Lida et al, 2007).
El entrenamiento de baja intensidad con oclusión vascular puede ser beneficioso tanto en el ámbito clínico como fuera de éste.
El entrenamiento con oclusión vascular puede ser utilizado por atletas para reponerse del estrés asociado a entrenamientos con sobrecarga de alta intensidad. También puede ser un estímulo efectivo para utilizar durante la fase de descarga de los atletas ya que éste resulta en adaptaciones positivas al entrenamiento, sin causar o causando muy poco daño muscular (Takarada et al, 2000).
En resumen, podemos afirmar que muchas personas no son capaces de soportar el alto estrés mecánico impuesto a las articulaciones durante el entrenamiento con sobrecarga de alta intensidad. Por ejemplo, los individuos de edad avanzada.
En cambio, el entrenamiento con sobrecarga de baja intensidad con oclusión vascular puede ayudar a reducir el riesgo de sarcopenia permitiendo que los individuos ancianos entrenen su sistema músculo-esquelético con intensidades muy bajas de entrenamiento.
CONCLUSIONES
Finalmente, estamos en condiciones de afirmar que el entrenamiento de baja intensidad con oclusión vascular parece ser un método único para promover la hipertrofia muscular y algunas adaptaciones neuromusculares.
Entrenar a intensidades del 20% de 1RM y obtener los mismos beneficios que si se entrenara al 65% de 1RM tiene implicaciones positivas para una variedad de poblaciones, particularmente las que no pueden manejar altas cargas mecánicas.
Esta también es una característica particular, ya que los estudios han mostrado ganancias de hipertrofia en tan poco tiempo como 3 semanas, con incrementos en los niveles de GH de hasta 290 veces por encima de los valores basales.
REFERENCIAS
Abe, T. y Cols. Effects of low-intensity walk training with restricted leg blood flow on muscle strength and aerobic capacity in older adults. J Geriatr Phys Ther. 2010; 33(1): 34-40pp.
Abe, T. y Cols. Muscle, tendon, and somatotropin responses to the restriction of muscle blood flow induced by KAATSU-walk training. Equine Vet J Suppl. 2006(36): 345-8pp.
Abe, T. y Cols. Muscle size and strength are increased following walk training with restricted venous blood flow from the leg muscle, Kaatsu-walk training. J Appl Physiol. 2006; 100(5): 1460-6pp.
Allen, DG, Whitehead, NP, and Yeung, EW. Mechanisms of stretch-induced muscle damage in normal and dystrophic muscle: Role of ionic changes. J Physiol 567:2005; 723–735pp.
Baar, K and Esser, KA. Phosphorylation of p70S6k correlates with increased skeletal muscle mass following resistance exercise. Am J Physiol 276.1999: C120–C127pp.
Behm, DG. Neuromuscular implications and applications of resistance training. The Journal of Strength & Conditioning Research. 1995; 9, 264-274 pp,
Burgomaster K. y Cols. Resistance training with vascular occlusion: Metabolic adaptations in human muscle. Medicine and Science in Sports and Exercise. 2003; 35(7): 1203-08pp.
Campos, G y Cols. Muscular adaptations in response to three different resistance-training regimens: specificity of repetition maximum training zones. Eur J Appl Physiol. 2002; 88(1-2): 50-60pp.
Clark, B. Relative safety of 4 weeks of blood flow-restricted resistance exercise in young, healthy adults.Scand J Med Sci Sports. 2010.
Cook SB, Clark BC, Ploutz-Snyder LL. Effects of exercise load and blood-flow restriction on skeletal muscle function. Med Sci Sports Exerc 2007: 39: 1708–1713 pp.
Drummond M, Fujita S, Abe T, Dreyer H, Volpi E, and Rasmussen B. Human muscle gene expression following resistance exercise and blood flow restriction. 2008. Med Sci Sports Exerc 40: 691–698 pp.
Fry, C. y Cols. Blood flow restriction exercise stimulates mTORC1 signaling and muscle protein synthesis in older men. J Appl Physiol. 2010; 108(5): 1199-209pp.
Fujita, S. y Cols. Blood flow restriction during low-intensity resistance exercise increases S6K1 phosphorylation and muscle protein synthesis. J Appl Physiol. 2007; 103(3): 903-10pp.
Gabriel, D.A., G. Kamen, and G. Frost. Neural adaptations to resistive exercise: mechanisms and recommendations for training practices. Sports Med. 36:2006.133–149pp.
Goldfarb, A. et al. Resistance exercise effects on blood glutathione status and plasma protein carbonyls: influence of partial vascular occlusion. European Journal of Applied Physiology. 2008; 104(5): 813-19pp.
Greenhaff, P et al. Energy metabolism in single human muscle fibres during intermittent contraction with occluded circulation. J Physiol. 1993; 460:443-53pp.
Hakkinen, K y Komi, PV. Electromyographic changes during strength training and detraining. Med. Sci. Sports Excerc. 1983; 15, 455-60 pp.
Hernández, JM.; Azael Herrero, J. Respuestas y adaptaciones al entrenamiento de fuerza oclusivo de baja intensidad. EFDeportes.com, Revista Digital. Buenos Aires, 2012. Año 16, Nº 164.
Hogan, M. et al Effect of gradual reduction in O2 delivery on intracellular homeostasis in contracting skeletal muscle. Journal of Applied Physiology. 1996; 80(4): 1313-21pp.
Jeremy Paul Loenneke and Thomas Joseph Pujol. The Use of Occlusion Training to Produce Muscle Hypertrophy. Strength and Conditioning Journal, 31(3) 2009; 77-84 pp.,
Karabulut, M. et al. The effects of low-intensity resistance training with vascular restriction on leg muscle strength in older men. Eur J Appl Physiol. 2010; 108(1): 147-55pp.
Kawakami, Y. The effects of strength training on muscular architecture in humans. Int J Sports Health Sci. 2005; 3:208-17pp.
Kraemer, W.et al American College of Sports Medicine position stand. Progression models in resistance training for healthy adults. Med Sci Sports Exerc. 2002; 34(2): 364-80pp.
Kubo, K. Effects of low-load resistance training with vascular occlusion on the mechanical properties of muscle and tendon. J Appl Biomech. 2006; 22(2): 112-9pp.
Kubota, A. et al. Prevention of disuse muscular weakness by restriction of blood flow. Med Sci Sports Exerc. 2008; 40(3): 529-34pp.
Laurentino, G. Effects of strength training and vascular occlusion. Int J Sports Med. 2008; 29(8): 664-7pp.
Loenneke, J. et al. Blood flow restriction: The metabolite/volume threshold theory. Med Hypotheses. 2011.
Loenneke, J. et al. A mechanistic approach to blood flow occlusion. Int J Sports Med. 2010; 31(1): 1-4pp.
Loenneke, J. et al. Acute and chronic testosterone response to blood flow restricted exercise. Horm Metab Res. 2011; 43(10):669-73pp.
Loenneke, J. et al. Low intensity blood flow restriction training: a meta-analysis. Eur J Appl Physiol, 2011.
Loenneke, J. et al. The use of occlusion training to produce muscle hypertrophy. Strength and Conditioning Journal. 2009; 31(3): 77-84pp.
Madarame, H. et al. Endocrine responses to upper- and lower-limb resistance exercises with blood flow restriction. Acta Physiol Hung. 2010; 97(2): 192-200pp.
Madarame, H. Effects of low-intensity resistance exercise with blood flow restriction on coagulation system in healthy subjects. Clin Physiol Funct Imaging. 2010; 30(3): 210-3pp.
Manini, T, and Clark B. Blood flow restricted exercise and skeletal muscle health. Exerc Sport Sci Rev. 2009; 37(2): 78-85pp.
Martín-Hernández, J. et al. El ejercicio físico suplementado con isquemia tisular como método de prevención de la atrofia muscular. Archivos de Medicina del Deporte. 2011;28(5):383-94pp.
Martín-Hernández, J. Et al. Revisión de los procesos de hipertrofia muscular inducida por el entrenamiento de fuerza oclusivo. Revista Andaluza de Medicina del Deporte. 2011.
Meyer R. Does blood flow restriction enhance hypertrophic signaling in skeletal muscle?. 2006. J Appl Physiol 100: 1443–1444 pp.
Moore, D. Neuromuscular adaptations in human muscle following low intensity resistance training with vascular occlusion. Eur J Appl Physiol. 2004; 92(4-5): 399-406pp.
Moritani, T et al. Oxygen availability and motor unit activity in humans. Eur J Appl Physiol Occup Physiol. 1992; 64(6): 552-6pp.
Murthy, G et al. Ischemia causes muscle fatigue. Journal of Orthopaedic Research. 2001; 19(3): 436-40pp.
Nakajima, T. et al. Use and safety of KAATSU training: Results of a national survey. Int J Kaatsu Training Res. 2006; 2:5-13pp.
Neto, GR et al. Effects of High-Intensity Blood Flow Restriction Exercise on Muscle Fatigue. Journal of human kinetics. 2014; 41:163-172pp.
Ohta, H. et al. Low-load resistance muscular training with moderate restriction of blood flow after anterior cruciate ligament reconstruction. Acta Orthop Scand. 2003; 74(1): 62-8pp.
Patterson S. and Ferguson R. Increase in calf post-occlusive blood flow and strength following short-term resistance exercise training with blood flow restriction in young women. Eur J Appl Physiol. 2010; 108(5): 1025-33pp.
Phillips SM. Short-term training: when do repeated bouts of resistance exercise become training. Can J Appl Physiol 2000; 25: 185-93 pp.
Pierce, J. et al. Growth hormone and muscle function responses to skeletal muscle ischemia. J Appl Physiol. 2006; 101(6): 1588-95pp.
Reeves, G. et al. Comparison of hormone responses following light resistance exercise with partial vascular occlusion and moderately difficult resistance exercise without occlusion. J Appl Physiol. 2006; 101(6): 1616-22pp.
Rus, R. et al. Effects of handgrip training and intermittent compression of upper arm veins on forearm vessels in patients with end-stage renal failure. Ther Apher Dial. 2005; 9(3): 241-4pp.
Sato Y. The history and future of KAATSU training. Int J Kaatsu Training Res. 2005; 1:1-5pp.
Sale, D. Neural adaptation to resistance training. Med Sci Sports Exerc. 1988; 20(5 Suppl): S135-45pp.
Shaw, J. and Murray, D. The relationship between tourniquet pressure and underlying soft tissue pressure in the thigh. J Bone Joint Surg (Am). 1982;64:1148-52pp.
Shinohara, M. et al. Efficacy of tourniquet ischemia for strength training with low resistance. European Journal of Applied Physiology and Occupational Physiology. 1998;77(1-2):189-91pp.
Schoenfeld, B. J. The mechanisms of muscle hypertrophy and their application to resistance training. Journal of Strength and Conditioning Research, 2010; 24, 2857–2872 pp.
Suga,T, Okita,K, Morita,N, Yokota,T, Hirabayashi,K, Horiuchi, M, Takada, S, Takahashi, T, Omokawa, M, Kinugawa, S, and Tsutsui, H. Intramuscular metabolism during low-intensity resistance exercise with blood flow restriction. J Appl Physiol 106:2009; 1119–1124pp.
Sumide, T. et al. Effect of resistance exercise training combined with relatively low vascular occlusion. J Sci Med Sport. 2009;12(1):107-12pp.
Takano, H. et al. Hemodynamic and hormonal responses to a short-term low-intensity resistance exercise with the reduction of muscle blood flow. Eur J Appl Physiol. 2005;95(1):65-73pp.
Takarada, Y. et al. Rapid increase in plasma growth hormone after low-intensity resistance exercise with vascular occlusion. J Appl Physiol. 2000;88(1):61-5pp.
Takarada, Y, et al. Cooperative effects of exercise and occlusive stimuli on muscular function in low-intensity resistance exercise with moderate vascular occlusion. Japanese Journal of Physiology. 2004;54(6):585-92pp.
Takarada, Y. et al. Applications of vascular occlusion diminish disuse atrophy of knee extensor muscles. Med Sci Sports Exerc. 2000;32(12):2035-9pp.
Takarada, Y. et al. Effects of resistance exercise combined with moderate vascular occlusion on muscular function in humans. J Appl Physiol. 2000;88(6):2097-106pp.
Takarada, Y. et al. Effects of resistance exercise combined with vascular occlusion on muscle function in athletes. Eur J Appl Physiol. 2002;86(4):308-14pp.
Tidball, JG. Mechanical Signal Transduction in skeletal muscle growth and adaptation. J. Appl. Physiol. 2005; 98, 1900-1908pp.
Vierck, J. Et al. Satellite cel regulation following myotrauma caused by resistance exercise. Cell biol Int. 2000; 24, 263-72pp.
Wernbom, M et al. Ischemic strength training: a low-load alternative to heavy resistance exercise? Scandinavian Journal of Medicine & Science in Sports. 2008;18(4):401-16pp.
Wernbom, M. et al. Effects of vascular occlusion on muscular endurance in dynamic knee extension exercise at different submaximal loads. Journal of Strength and Conditioning Research. 2006;20(2):372-77pp.
Wernbom M, Jarrebring R, Andreasson MA, Augustsson J. Acute effects of blood flow restriction on muscle activity and endurance during fatiguing dynamic knee extensions at low load. J Strength Cond Res 23: 2009; 2389 –2395pp.
Wernbom M et al. Acute low-load resistance exercise with and without blood flow restriction increased protein signalling and number of satellite cells in human skeletal muscle. Eur J Appl Physiol. 113: 2013; 2953-65pp.
Wilkinson, S. et al. Hypertrophy with unilateral resistance exercise occurs without increases in endogenous anabolic hormone concentration. Eur J Appl Physiol. 2006;98(6):546-55pp.
Yasuda, T. Effects of low-intensity bench press training with restricted arm muscle blood flow on chest muscle hypertrophy: a pilot study. Clin Physiol Funct Imaging. 2010;30(5):338-43pp.
Yokokawa, Y et al. Effects of low-intensity resistance exercise with vascular occlusion on physical function in healthy elderly people. Biosci Trends. 2008;2(3):117-23pp.
¿Querés aprender más? Elegí alguno de nuestros cursos y pagalo con un 20% de descuento si ya sos miembro. ¿Aún no sos miembro? ¡Dale clic acá y sumate!







